Dette foredraget ble holdt under CHERUBS konferansen i Salt Lake City i 2017 av Dr. Kays ved John Hopkins All Children’s Hospital, Florida, USA. Det er transkribert og oversatt til Norsk av Andrea Wiik.
Vi har undervurdert disse barna i alt for lang tid. De klarer seg så mye bedre enn hva den generelle oppfattelsen er innenfor det medisinske felleskapet – men det er i ferd med å endre seg, og folk vil forhåpentligvis snart begynne å få øynene opp. På tvers av landet ser vi dessverre hele spekteret av spådommer: «babyen din kommer ikke til å overleve», «babyen din kommer til å bli hjerneskadet», og «du må avbryte dette svangerskapet». Vi jobber for å endre dette synet og få folk til å innse hvor fantastisk godt flertallet av disse barna klarer seg. Det er fortsatt utfordrende å behandle CDH. Det krever svært raffinert behandling og erfarent helsepersonell, men det handler om barnas potensiale – for de har et fantastisk potensiale!
Jeg vil at dere merker dere at når jeg snakker om CDH så snakker jeg med utgangspunkt i en database på 360 barn som jeg har behandlet gjennom min karriere så langt. Men jeg vil starte med å hedre dere som er foreldre til disse barna, den reisen dere har vært på, og den veien dere fortsatt har foran dere. Vi støtter alle fremskritt innen CDH og vi jobber alle sammen med denne sykdommen, men det finnes betydelige kontroverser om hvordan man skal behandle den. Jeg kommer til å fortelle vår historie. Og jeg kommer til å være fullstendig ærlig og fortelle deg hva vi tror er rett, og hvorfor vi tror det er det rette å gjøre. Det kan være det er i strid med det du har lært. Målet mitt er ikke på noen måte å undergrave den tilliten du har til legen din, men det gir ingen mening for meg å komme hit uten å fortelle hva vi har gjort og hva vi tror på, og hvorfor vi tror på det. Så ha det gjerne i bakhodet. Jeg anerkjenner deg, legene og alle andre som har behandlet og tatt seg av barnet ditt.
Så, hva har vi lært etter å ha behandlet 360 barn med CDH? Vi har lært at det finnes behandlingsprinsipper som bør følges hvis vi skal klare å få det høyeste potensialet ut av disse barna. Jeg kommer til å snakke mye om data og resultater, men jeg går også litt inn på fremtidig utvikling.
Hvorfor er det viktig å bli god til å behandle CDH?
CDH er viktig, og den har betydning av mange grunner. Flere ser ut til å tenke at det bare er en liten «orphan disease», (Begrepet orphan disease, inkluderer sjeldne sykdommer, og brukes om forsømte tilstander hvis behandlinger ofte ikke anses som lønnsomme på grunn av kostnadene for utvikling og begrenset pasientpopulasjon). For hvor viktig kan 1500 barn i året egentlig være? Forferdelig viktig spør du meg, også på et mye høyere nivå enn enkeltindividet. For hvis vi lærer oss å bli virkelig gode på å behandle disse barna, de aller sykeste barna på nyfødtintensiven, så kan vi også ta enda bedre vare på alle de andre barna. Slik jeg ser det er dette derfor mye større enn kun et diafragmahernie.
I 2014 ble det grovt estimert født i overkant av fire millioner barn i USA. Av disse ble 800 født med gastrochise og færre enn 100 av dem døde. (Et barn som har gastrochise blir født med tarmene utenfor kroppen.) Videre vil ca. 500 utvikle Wilms tumor (en type barnekreft) og færre enn 100 av dem vil dø (statistisk sett). Men 1300-1500 fostre vil diagnostiseres med CDH (ingen vet nøyaktig antallet så dette er kun et estimat, men det gir en indikasjon) og minst halvparten av dem kommer til å dø. Mange av dem fordi graviditeten avbrytes. Vi vet ikke hvor mange det er snakk om. Og blant dem som blir født, er overlevelsesraten ved sykehus med en interesse for CDH på om lag 70 %. Overlevelsesraten ved sykehus som ikke har interesse for å behandle CDH er sannsynligvis enda lavere. Jeg vil påstå at den generelle overlevelsesraten ganske sikkert er 50 % eller enda dårligere om du regner med alle selvvalgte aborter.
Pulmonal hypoplasi og pulmonal hypertensjon
CDH er i mange tilfeller en dødelig fødselsdefekt. I de aller mest alvorlige tilfellene hvor det er svært lite eller ingen lunge igjen på venstre side, og hjertet er forskjøvet helt over til høyre, er det nesten ingen lunge igjen på denne siden heller. CDH er en sykdom som påvirker begge sider av kroppen, ikke kun den siden hvor brokket er. Dette kalles pulmonal hypoplasi: lungene er for små. Det er også mye snakk om pulmonal hypertensjon i forbindelse med CDH. Alle med personlig erfaring med CDH har hørt legene prate om dette. Jeg håper å kunne refokusere dette samtaleemnet, for selv om disse barna absolutt har pulmonal hypertensjon, bør det ikke være der fokuset ligger når det kommer til behandling. Dette fokuset bør være på de underutviklede lungene. Hvis vi behandler de små lungene, har pulmonal hypertensjon en tendens til å bedres over tid. Ved å fokusere på pulmonal hypertensjon, går du glipp av muligheten til å behandle lungestørrelsen. Jeg har troen på at denne dialogen vil endres, spesielt når vi nå publiserer et stort forskningsprosjekt om noen få måneder. Og ikke misforstå meg, pulmonal hypertensjon er et veldig viktig emne, men det finnes to komponenter av pulmonal hypertensjon og det er viktig å forstå forskjellen. Den første er en reaktiv variant som oppstår de første få dagene etter fødsel. Dette skjer hos alle barn, uavhengig av om de har et medfødt diafragmahernie eller ikke. Og så er det den langsiktige varianten som er relatert til hypoplastiske lunger. Og når vi kjenner til dette bør fokuset være på å hjelpe de små lungene med å vokse seg så store som mulig.
Vurdering av alvorlighetsgrad ut ifra leverens posisjon
CDH er et spektrum av sykdom, fra mindre alvorlig på venstre side av skalaen, til sinnsykt alvorlig i den andre enden, og barna som fødes med CDH befinner seg på forskjellige steder langs hele denne linjen. Når vi skal vurdere alvorlighetsgrad kan vi se på hvor mye organer som er i brystet. Da ser vi anatomisk på situasjonen og det kan være veldig hjelpsomt. Det viktigste vi ser etter hos venstresidig CDH er hvordan leveren er posisjonert. Er leveren på undersiden av mellomgulvet er pasienten på den milde siden av det anatomiske spekteret, og er leveren på oversiden er alvorlighetsgraden på den mer alvorlige siden. Høyresidig CDH er et sted midt i mellom, men gruppemessig nærmere venstresidig CDH med lever opp.
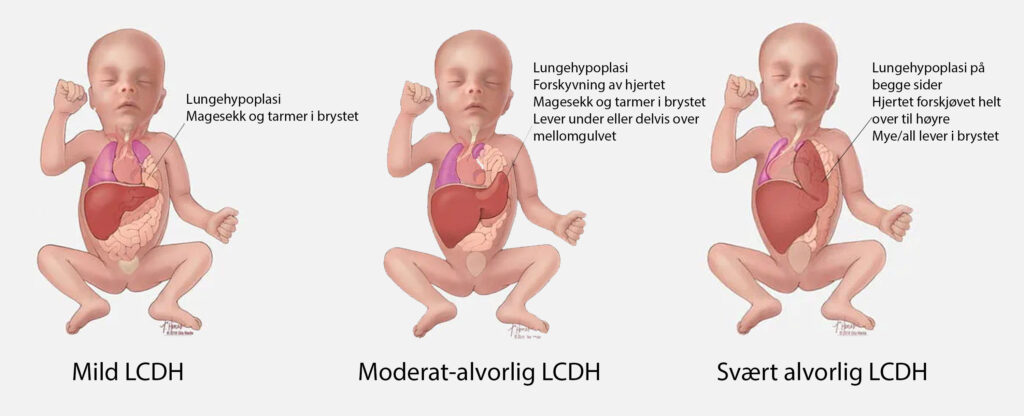
De aller mildeste tilfellene av venstresidig CDH er de hvor magesekken er på undersiden av mellomgulvet, for da er nesten utelukkende alltid leveren også nede. Disse barna har en svært god prognose. Går vi ett trinn opp på den anatomiske alvorlighetsskalaen finner vi tilfellene hvor magesekken ligger over mellomgulvet, men stadig med leveren under. I disse tilfellene er hjertet forskjøvet mot høyre. Enda ett trinn opp er pasientene med deler av leveren på oversiden av mellomgulvet. Her er hjertet skjøvet helt over til høyre side. Og helt øverst på skalaen finner vi de sinnsykt alvorlige tilfellene, der hvor hele leveren ligger i brystet. I disse tilfellene har den høyre lungen nesten ikke luft i seg i det hele tatt. Årsaken til at barna i den lavere enden av skalaen klarer seg bedre, er på grunn av at lungen på motsatt side av defekten er mindre komprimert.
Du kan ikke se leveren godt på et thoraxrøntgen i de fleste tilfeller, du trenger ultralyd eller CT eller andre metoder for å si noe om hvor leveren ligger. Siden de fleste barn nå er diagnostisert før de blir født, kjenner vi også som regel til plasseringen av leveren. I de alvorligste tilfellene hvor det nærmest ikke finnes fungerende lungevev, er gassutvekslingen, med andre ord det arbeidet lungen skal gjøre for å flytte oksygen inn i blodet og karbondioksid ut, sterkt begrenset. PH-verdiene vi måler i barnets blod en time etter fødsel bør være 7,4. En syk baby har kanskje en verdi på 7,2, og en skikkelig syk baby kan ligge på 7,0. Alt under dette er ansett som svært alvorlig. Hos de mest alvorlige venstresidige CDH-pasientene har vi for eksempel sett verdier på 6,64 med pCO2 på 130 og et oksygennivå i blodet på 15. De fleste vil si at det er et liv som ikke kan berges.
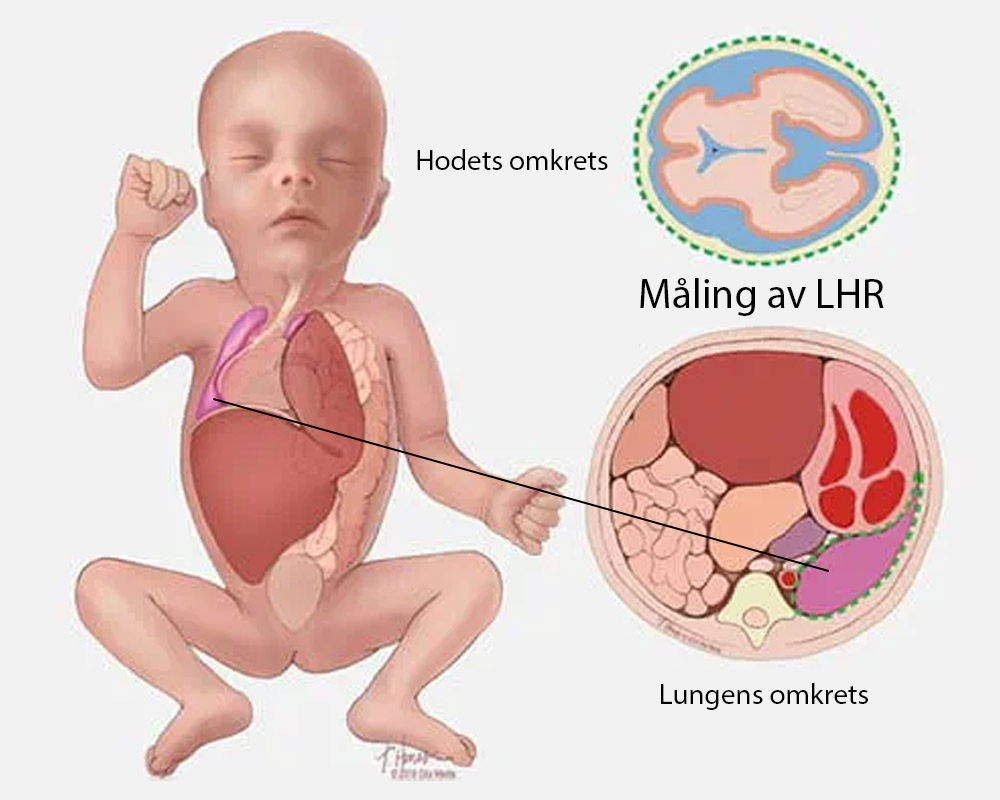
Vurdering av alvorlighetsgrad ut ifra LHR
For å vurdere alvorlighetsgrad kan du også se på lungen på motsatt side av defekten. Lung to Head Ratio (LHR) ble utviklet av Dr. Michael Harrison og teamet hans ved University of California, San Francisco. Metoden har eksistert i lang tid og er en måte å beregne hvor god lungen på motsatt side er. Generelt kan man ikke se lungen på den affiserte siden godt på prenatale bilder, derfor ser vi på lungen på motsatt side. For å gi et bilde på hva vi ser etter ved LHR, er en verdi større enn 1,4 regnet som mindre alvorlig, 1,0-1,4 er mer alvorlig og under 1,0 er veldig alvorlig. Blant alle 360 pasientene jeg har behandlet, hadde gjennomsnittet en LHR verdi på 1,5. Blant de som døde var gjennomsnittet 1,0 og blant de som overlevde var den på 1,6. Dette viser et tydelig bilde av at mindre lunger er mer alvorlig og mer utfordrende å behandle. Men disse er gjennomsnitt og de taler ikke for hvert individ. Utfordringen med LHR er at du kan undersøkes av tre ulike fostermedisinere og få tre ulike LHR-verdier. Det er med andre ord ikke en verdi vi drar en sluttlinje utifra, men det er data vi kan bruke for å tegne oss et bilde av hvor sykt barnet er. En annen utfordring med LHR er at verdien stiger etter hvert som fosteret vokser. Lungen vokser raskere enn hodet, og derfor blir tallet bedre, men barnet blir ikke bedre. Barnets tilstand forblir den samme. Ideelt måler vi LHR mellom uke 23 og 26. Hvis vi måler etter dette legger vi til en korrigering, slik at vi kan regne ut en observert verdi av LHR i forhold til forventet LHR. Når vi beveger oss ut av 26-ukers vinduet, må vi se mer på disse tallene. LHR er et viktig tall, men vi bør ikke definere barnets overlevelsessjanser utelukkende på ett stykke data.
Vurdering av alvorlighetsgrad ut ifra fysiologiske verdier
Frem til nå er alt vi har gjort å ta bilder av barna og forsøke å forutse hvordan de vil klare seg. Mennesker tar også bilder av skydannelse og forteller deg hvorvidt det vil regne i morgen. Hvor ofte stemmer dette? Sannsynligvis de fleste gangene, men ikke alltid. Det er viktig å forstå at våre antakelser om hvordan barnet vil klare seg er håpefulle, men grunnleggende ufullkomne. Først når barnet er født blir teori til praksis. Da kan vi se på fysiologien. Hvor godt arbeider barnets hjerte og lunger sammen? Vi vet at fødselsvekt er relatert til alvorlighetsgrad, Apgar-score er relatert til alvorlighetsgrad, og barnets blodgassverdier én time etter fødsel er relatert til alvorlighetsgrad. CDH Group har også utarbeidet en ligning som til en viss grad kan forutsi alvorlighetsgrad. Barnet fødes, resusciteres og intuberes. Vi gjør vårt aller beste i løpet av den første timen, og så tar vi en blodgass (pH, pCO2 og PO2). Denne er svært prediktiv for hvor syk babyen vil være. Det er en høy korrelasjon mellom alvorlighetsgrad og overlevelsesgrad. Fysiologiske tiltak i de første timene av barnets liv, kan forutsi nøyaktig hvor sykt barnet vil være.
Hvis vi nå tar anatomien og slår den sammen med fysiologien kan vi se hvordan de er relatert:
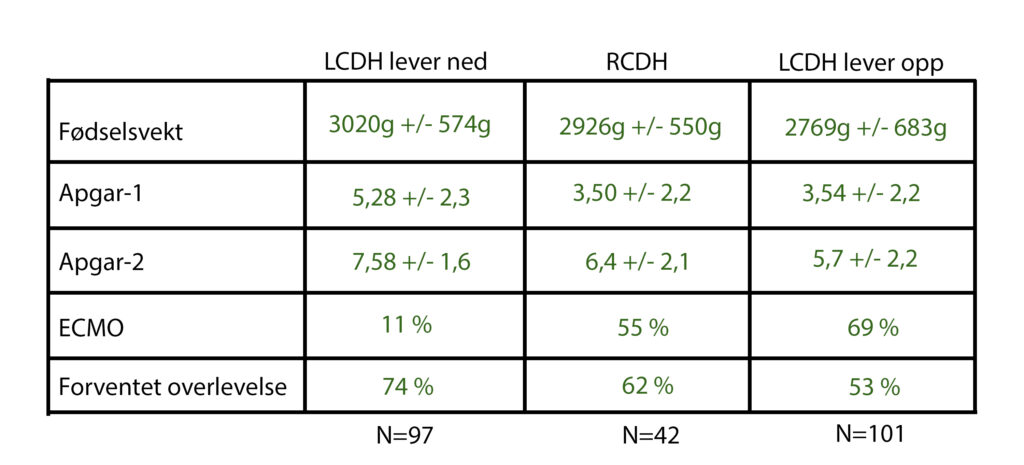
LCDH-barn med lever ned har en tendens til å være større enn RCDH-barn, som igjen pleier å være større enn LCDH med lever opp. Apgar-score er som regel høyere ved LCDH lever ned enn ved RCDH, og enda lavere ved LCDH lever opp. Legg merke til hvordan tallene synker når vi beveger oss bortover på tabellen. Ved fem-minutters Apgar ser vi samme trend, risikoen for ECMO går opp og forventet overlevelse går ned. Dette viser hvordan fysiologi og anatomi henger sammen hos CDH-barn.
Som tidligere nevnt er den mest alvorlige anatomiske gruppen de som har et venstresidig diafragmahernie med leveren opp. Det betyr ikke at en høyresidig defekt ikke kan være alvorlig, noe den kan, og det betyr ikke at en venstresidig defekt med leveren ned ikke sporadisk kan være alvorlig også. Men gjennomsnittlig er barna med LCDH og lever opp de mest alvorlig syke anatomisk. Denne defekten påvirker flest organer og har den mest alvorlige graden av lungehypoplasi. Overlevelsesraten i denne gruppen er 45 % basert på metaanalyse og også 45 % basert på forskning fra et ledende sykehus innen CDH-behandling. Metaanalyse vil si at noen har sett på flere publiserte forskningsartikler og lagt sammen resultatene og kommet frem til ett tall. Dette gir en pekepinne på hva overlevelsesraten er for disse pasientene.
CDH som en del av et større sykdomsbilde og som en isolert misdannelse
Nå for tiden diagnostiseres de aller fleste barna før de blir født. Så hva forteller vi familiene når vi prater med dem? Dessverre har rundt 10 % av den totale gruppen barn med CDH også andre livstruende, store anomalier. Ved store, mener jeg et hjerte som kun har én ventrikkel, eller et stort kromosomavvik, eller et stort genetisk avvik. Jeg snakker ikke om de små genetiske variasjonene, men de av stor betydning. Det gjelder også de som har multiple anomalier på en gang. Disse barna tilhører en helt annen gruppe og mange ganger velger vi å ikke behandle disse barna like aggressivt, fordi vi ikke vil la dem gjennomgå noe som de med lite sannsynlighet vil ha et godt utfall av. Men dette er en veldig personlig avgjørelse som legene og barnets foreldre tar sammen etter å ha sett på barnets data. Så har du resten av de 90 % som har et såkalt isolert CDH. Det behøver ikke å være fullstendig isolert, barnet kan for eksempel mangle en nyre, og det er viktig å vite, men det vil ikke påvirke barnets overlevelsessjanse. Har barnet et hull i hjertet mellom de to ventriklene er det også viktig å vite, men det vil heller ikke ha noen betydelig påvirkning på overlevelsesraten. Så når jeg snakker om de 10 % som har store anomalier, snakker jeg om anomalier som i utganspunktet er dødelige i seg selv. Hvis du så legger til CDH er det en nokså dyster kombinasjon.
De 5 prinsippene for optimal behandling av CDH
Har du noen gang spilt baseball eller softball, har du sikkert lært at det grunnleggende i sporten er å kaste og fange ballen, løpe til basen, og slå ballen. På samme måte har vi en grunnleggende behandling for CDH bestående av 5 prinsipper som vi har lært oss gjennom behandlingen av de siste 360 pasientene:
- Fokuser på lungene
- Reparer defekten
- Tilby ECMO
- Kartlegg risiko for å spesifisere behandling
- Ha troen på at barnet kan overleve
Fokus på lungene
Jeg startet å jobbe ved University of Florida i 1992. Den første forskningsrapporten vi skrev baserte seg på en såkalt snillere og mildere ventilasjon. Det var ikke jeg som oppfant det, jeg var bare en hermekråke. Han som oppfant det var en fyr ved navn Jen Wung. Han er en kinesisk anestesiolog som kom fra Kina til USA. Han kunne ikke få legitimasjon innenfor anestesi i USA, men han kunne bli legitimert som neonatolog, så han arbeidet som neonatolog med bakgrunn i anestesi. På 80-tallet arbeidet han med å endre behandlingen til alvorlig lungesyke barn (ikke barn med CDH), ved å gi akkurat nok ventilering til å holde barna i live, i stedet for å skru opp ventilatoren. Han så at restitusjonspotensialet til disse barna langt oversteg de barna hvor helsepersonellet fortsatte å skru opp respiratoren for å prøve å gjøre dem friskere. I 1985 publiserte han en banebrytende artikkel innen pediatri, om nettopp snillere og mildere ventilasjon, som et konsept og ikke kun til én pasientgruppe. Jeg hadde praksis ved Columbia University og ble marinert i dette miljøet, så jeg tok med meg konseptet til University of Florida og begynte å bruke det på CDH-pasienter. Charlie Stolar gjorde det samme, under Jen Wungs ledelse, samt Jenny Wilson og Austin. Vi diskuterer oss i mellom hvem som var først ute, men det spiller ingen rolle. Jen Wung var den som startet det hele. Vi startet med denne protokollen i august 1992, og sluttet fra da av å overventilere barna. Vi tror at hyperventilering/alkalose, som før var «standardbehandling» skadet pasientene. Vi endret dette og de påfølgende 16 pasientene vi behandlet fikk en helt ny behandlingsprotokoll:
- Lett til moderat sedasjon (ingen paralyse)
- Konvensjonell trykkontrolert (PLV) ventilasjon stilt inn etter pasientens komfort og kliniske status
- Laveste trykk som gir tilstrekkelig brystbevegelse (vanligvis 20-24 cmH2O)
- Sjelden PIP >25 cmH2O, vanligvis kun ved overgang til ECMO (konstant luftveistrykk <12 cmH2O)
- Hyperventilasjon og alkalose skal strengt unngås
Rett etter fødsel gav vi barna kun en lett sedasjon. Vi la dem på en mildere og snillere ventilator med et trykk som var akkurat nok til å blåse opp lungene og heve brystet tilstrekkelig. Vi holdt trykket under 25 cmH2O, som var vårt skjæringspunkt mellom for høyt trykk og akseptabelt trykk. Vi unngikk overventilering og endring av pH i et forsøk på å påvirke pulmonalkretsløpet. Vi la oss på et litt høyere nivå av CO2 med et mål på 40-60, men en toleranse på 60-70, og en medium verdi av PO2 på 80-110, men tolererte mye lavere verdier hvis barnet ikke hadde det så godt. Målet vårt var aldri en perfekt CDH-pasient, målet var at pasienten var god nok. Så vi gav støttebehandling til situasjonen var god nok, fordi økt støtte betyr økt toksisitet, og målet vårt var å bevare parenkym (det vil si de cellene som skaper organets spesifikke funksjon).
Dette var det vi fant: Vi sammenlignet disse pasientene med tidligere pasienter som hadde blitt overventilert. I tilfellene hvor barna hadde ligget på høyt trykk hadde 83 % endt med pneumothorax. Der lungene hadde blitt utsatt for et medium trykk, hadde 43 % fått en pneumothorax. Små babyer med små lunger som deretter punkterer, er ingen god kombinasjon. Hos pasientene hvor vi sluttet å pushe lungene like hardt, så vi kun pneumothorax hos 2 %. Hvordan påvirker dette overlevelsen? Der vi la pasientene på nokså høyt trykk overlevde ca. 20 %. Der vi gav medium mengde trykk og etterfølgende la dem på ECMO overlevde 50 %. Der vi gav lungene mindre trykk, og fortsatt hadde ECMO i backup, så vi at overlevelsesprosenten plutselig skøt opp til 80 %. Dette var helt uhørt i 1992. Vi kunne ikke klart dette uten ECMO, så jeg vil ikke at dere skal tro at ingen av disse pasientene hadde behov for ECMO, noen av dem hadde det. Men når de først endte opp på ECMO var ikke lungene deres skadet, vi kunne få dem gjennom behandlingen og lungene var fortsatt i god behold etterpå. Og overlevelsen steg til et nivå ingen trodde var mulig. Vi konkluderte med at vi var nødt til å bli kvitt all iatrogen lungeskade. En iatrogen skade betyr at det var vi som gjorde det – vi skadet lungene deres ved å skru for høyt opp på ventilatoren. Som leger må vi være forsiktige. Og vi lærte at antall CDH-barn som overlever handler utelukkende om hvor godt vi tar vare på lungene deres.
Som et resultat av denne forskningen begynte vi å få henvisninger fra rundt om i landet og verden. Jeg jobbet da ved University of Florida, nå er jeg ved John Hopkins. Vi er et høyt trafikkert henvisningssykehus med en høy prosentandel av prenatalt diagnostiserte pasienter. For å gi deg et innblikk i vår henvisningsbase kan du se for deg at du for eksempel bor i Seattle. Vil du da komme hele veien til Florida hvis barnet ditt har en mindre alvorlig CDH-diagnose? Nei, du kommer hit fordi legen din har sagt at babyen din kommer til å dø. Det er da du går på nettet og søker etter andre steder du kan reise. Så den gjennomsnittlige alvorlighetsgraden vi behandler er med andre ord signifikant høyere enn ved andre sykehus, på grunn av de nasjonale henvisningene.
Reparere mellomgulvsbrokket
Prinsipp nummer to er å reparere mellomgulvsbrokket. Dette er et svært viktig steg, men også svært kontroversielt. Statistisk sett når et brokk opereres hos oss overlever 90 %. Opereres brokket aldri, overlever 0 %. De fleste pasientene opereres åpent. Enkelte kan opereres torakoskopisk, men det er også litt kontroversielt. Vi ser på dette som en livsnødvendig operasjon, og vi vil gjøre vår aller beste, og som hovedregel gjør vi da åpen kirurgi. Vi har gjort noen torakoskopiske operasjoner, men det er ikke det vi foretrekker. Når vi sier at operasjon er så viktig, hvorfor i all verden skulle vi ikke da alltid operere defekten? Som nevnt tidligere forekommer det tilfeller med assosierte, alvorlige anomalier (kromosomavvik, enkel ventrikkel, eller skade på sentralnervesystemet) og valget kan da falle på å ikke gå all in for å behandle barnet. I andre tilfeller kan barnet bli operert for sent. Slike tilfeller kan starte med at barnet fødes, ventileres, viser bedring en stund, men så blir dårligere. Barnet blir lagt på ECMO og det går kanskje ikke så bra, og barnet overlever ikke. Det kan også være at avgjørelsen er å vente til barnet er bedre og kan tas av ECMO igjen, men barnet blir aldri bedre og kommer aldri av ECMO i live. Spørsmålet er om det barnet som døde under ECMO-behandling kunne ha overlevd om en annen tilnærming hadde vært tilfellet?
Ikke misforstå meg, å operere et barn på ECMO er ingen enkel sak. Det er et svært stort kirurgisk inngrep som utføres på en pasient som ofte er hypervolemisk og hvor blodet er fullstendig antikoagulert fra ECMO-maskinen. Mange kirurger har dårlige erfaringer med å utføre en slik operasjon, noe som er årsaken til at mange sykehus ikke vil operere barnet før det er stabilt nok til å komme av ECMO. Dessverre mener jeg at de barna som dør på ECMO før operasjon, potensielt kunne vært restituert. Så vi trenger å løfte frem et paradigme som gjør at vi kan behandle alle barna, enten de kommer av ECMO eller ikke. Det jeg vil få frem er at når du gjør operasjonen av stor betydning. En ting er at vi bestemmer oss for at vi vil ha operasjonen gjennomført, men samtidig vil vi gjøre det på et tidspunkt som har lavest mulig risiko. I tillegg til dette har vi kanskje ytterligere risiko å ta hensyn til, og barna har forskjellige typer risiko, fordi de befinner seg på ulike steder av spekteret. Så hvordan kommer vi frem til når vi skal operere? Og er det så enkelt som one size fits all? Kan alle pasientene dra nytte av den samme planen eller bør den være ulik basert på hvor på alvorlighetsskalaen barnet befinner seg?
Å time operasjonen riktig
I en artikkel vi har publisert har vi sett på timing for operasjon relatert til ECMO, basert på alvorlighetsgrad. Med andre ord, hva gjør vi med et LCDH-barn med lever opp eller lever ned, og hva gjør vi med et RCDH-barn? Spiller det noen rolle hva vi gjør? Nøkkelpunktene som kom frem i studien var at det egentlig ikke spilte noen rolle når du utførte operasjonen på barna som ikke hadde behov for ECMO. Det var likegyldig om det var på dag 3, 4, 5, eller 6. Jeg er ingen tilhenger av å vente lenger enn 6 dager, men en artikkel av CDH Study Group viser at overlevelsen ikke ser ut til å endre seg mye så lenge du ikke behøver ECMO.
På den annen side endrer overlevelsen seg mye hvis du trenger ECMO. Hvis et barn, uansett alvorlighetsgrad, ender opp på ECMO er overlevelsessjansen nasjonalt 50 % (tall fra ELSO). Dette er mye lavere enn jeg mener vi bør kunne oppnå. Vi har stått fast på 50 % i et par tiår nå, hvor vi ikke har gjort noen som helst fremgang vedrørende overlevelsen til CDH-barn på ECMO. Det betyr ikke at det ikke er sykehus som er blitt bedre på dette området, men i det store bildet er det ikke bra. Vi har spurt oss selv: i tilfeller hvor et barn har behov for ECMO, er det da bedre om det opereres før ECMO eller om det legges på ECMO uten korrigering av brokket?
Vi så på barna med LCDH og lever ned, og konkluderte med at de har en overlevelsesrate på 99 % hos oss, uavhengig av om de opereres før, under eller etter ECMO. Så godt som alle overlever. Men vi oppdaget at hvis vi opererte dem i løpet av de første 48 timene, var risikoen for at de ville trenge ECMO faktisk høyere. Var det fordi vi valgte ut de som var sykest, eller var det fordi vi ved å utføre operasjonen, destabiliserte barnet som var i en prosess med å bli stabil? Vi kom frem til at disse barna ville ha en fordel av å vente med operasjonen forbi de første 48 timene, så det er det vi alltid gjør nå. Alle LCDH med lever ned stabiliseres i minst 48 timer før vi opererer. Ender de opp på ECMO, så gjør de det ikke fordi vi gjorde noe feil.
Deretter så vi på barna med LCDH og lever opp. Hvis du husker tilbake til statistikken, så er dette gruppen med barn som har en mortalitet på 45 %. Det vi så var at hvis vi opererte dem innenfor de første 48 timene, endret ikke risikoen for om de ville behøve ECMO seg. Det samme gjalt om vi opererte dem innenfor de neste 48 timene. Men overlevelsesraten hvis vi opererte dem før de ble lagt på ECMO var mellom 90-100 %, mens hvis vi opererte dem på ECMO eller etter de ble tatt av, var sjansen for å overleve statistisk sett kraftig redusert. Vi tolket dette som at vi var nødt til å være mer aggressive i behandlingen av de mer alvorlig syke barna, altså de med leveren over mellomgulvet. Det er nesten kontraintuitivt, men jo sykere de er jo mer trenger de operasjonen. Allikevel er den nasjonale oppfattelsen fortsatt at jo sykere de er, jo mer trenger de å stabiliseres først. Dette er med andre ord et av områdene hvor vi beveger oss motstrøms i forhold til hva de fleste andre gjør.

Når skal du holde tilbake og når skal du raske på?
Grafen over viser forholdet mellom alvorlighetsgrad og tidspunkt for operasjon. Pasientene til venstre har færre organer i brystet. De har reaktiv pulmonal hypertensjon, det vil si at hvis du plager dem blir det verre, og lar du dem være i fred blir det bedre. Så lenge barnet befinner seg i den nedre delen av spektrumet bør du la dem være i fred, la de stabilisere seg og gjøre operasjonen først når den pulmonale hypertensjonen er mindre.
I den andre enden av spekteret blir lungene mindre og mindre når vi beveger oss fra venstre mot høyre. Disse barna har persisterende pulmonal hypertensjon. Denne er forårsaket av at lungene er for små, og det er ingenting ventetid alene kan gjøre for å få dem til å vokse seg større uten å operere. Det er viktig å forså at det er ulike ting som påvirker pulmonal hypertensjon. Noen ting kan vi påvirke, mens andre er vanskeligere å gjøre noe med. Pasientene i den mildere enden av spektrumet vil ha en fordel av å vente med operasjon, mens de mer alvorlig syke vil ha en fordel av å opereres tidlig – for å faktisk bli operert i det hele tatt. For vi har allerede konkludert med at å operere brokket er veldig viktig for overlevelse.
Operasjon før eller etter ECMO?
I en studie vi publiserte for et par år siden sammenlignet vi barn med venstresidig diafragmahernie og lever opp. 20 av dem ble lagt på ECMO uten operasjon, og 22 ble operert og trengte ECMO i etterkant. Vi sammenlignet alle mulige verdier som forteller noe om alvorlighetsgrad, slik som Apgar score etter 1 og 5 minutter, forventet overlevelse, LHR-verdi, og observert LHR, pH, PO2 og PCO2 1 time etter fødsel, risikovurdering for ECMO, med mer, og vi fant ut at disse to gruppene var så godt som identiske. Men overlevelsesraten for de som ble lagt på ECMO uten operasjon var 65 %, mens den var på 96 % hos de som ble operert først. Å lukke brokket før behandling med ECMO så ut til å være en god ting. Barna som ikke overlevde hadde komplikasjoner på ECMO og de ble ikke operert, eller de ble operert for sent.
Kan vi forutsi behovet for ECMO?
Ved å se på blodgassverdier (pH, PO2, PCO2) samt lungestørrelse ved hjelp av LHR, og så legge disse verdiene sammen i en fancy statistisk ligning, kan vi faktisk forutsi risikoen for om barnet vil trenge ECMO allerede innenfor den aller første levetimen. Det betyr ikke at vi i så fall vil legge barnet på ECMO innen en time, men det er en antagelse som stemmer 90 % av tiden. Derfor bruker vi nå disse ligningene for å hjelpe oss med å få et bilde av alvorlighetsgraden til barnet. Vi tar altså både fysiologisk data og data om lungestørrelse og blander dem sammen. Vi bruker data fra to forskjellige steder til å hjelpe oss med å skape denne type informasjon, og det synes jeg er ganske stilig.
Skal bruken av ECMO begrenses i tid?
Noen sykehus setter en grense, hvor du for eksempel får 14 dager på ECMO, og det er det. Gir det noen mening? Støtter dataene det? Vi så nærmere på våre egne data fra over 100 barn med CDH på ECMO for å svare på dette. Kan vi finne ut hvor lenge vi skal bruke ECMO, og kan vi egentlig bestemme en grense hvorfra vi mener at barna ikke kommer til å bli noe bedre? Vi så at hvis barnet kom av ECMO i løpet av de første 10 dagene, hadde det en veldig høy overlevelsessjanse – og det gir mening siden barnet raskt ble bedre. Men hva hvis barnet fortsatt ligger på ECMO etter 14 dager? Hos oss er overlevelsessjansen 56 % på det tidspunket. Disse tallene har forresten ingenting med å skulle bestemme hvor lenge vi skal behandle å gjøre, vi tar pasientene våre av når de viser bedring. Er barnet fortsatt på ECMO etter to uker, betyr det bare at det ikke er bedre enda. Etter tre uker er overlevelsesraten 46 %. Etter fire uker er den på 43 %. Etter fem uker på ECMO er det stadig én av fire som vil overleve. Deretter ser vi et tydelig fall.
Vi så også at barn som kun hadde én runde med ECMO klarte seg mye bedre enn de som kom av, ble dårlige og måtte tilbake på ECMO. Andre runde med ECMO redder noen liv, men ikke så mange som etter første runde. Vi forsøkte også å se om vi kunne forutsi hvor lenge et barn ville ligge på ECMO utifra hvor syke de var, og det kunne vi. Enkelt forklart, jo sykere barnet var når det ble lagt på ECMO, jo lengre behandling var det behov for. Det er ikke one size fits all, sykere barn trenger mer tid på å bli friske. Dermed er nok ikke det å begrense behandlingen til et bestemt antall dager den beste tilnærmingen. Men husk at dette er basert på våre data. Andre sykehus kan ha veldig lav overlevelse etter to uker og kan ha satt slike grenser utifra sine resultater. Det vi forsøker å få frem er hva som er mulig å oppnå, hva som er potensialet til disse barna. Vi så at pasienter med LHR over 1,0 hadde kortere ECMO-behandling enn de med LHR under 1,0, med andre ord, større lunger blir raskere friske.
Øker ECMO overlevelsessjansen?
Dette er det faktisk en stor kontrovers rundt, og jeg tror det er fordi kun 50 % av barn på ECMO overlever. Det finnes sykehus, hovedsakelig i Europa, som ikke bruker særlig mye ECMO-behandling og allikevel rapporterer om høy overlevelse. Og vi har sykehus i USA som også rapporterer om høy overlevelse, hvor én gruppe bruker ECMO og en annen ikke gjør det. Kan vi sammenligne disse gruppene? Fordi det er vanskelig å sammenligne dem, og ikke alle rapporterer de samme dataene, er det virkelig utfordrende å vitenskapelig påstå at du vet hvorvidt ECMO øker sjansen for overlevelse eller ikke. Jeg er personlig overbevist om at god bruk av ECMO, utført til rett tid, på pasienter som blir operert, absolutt øker overlevelsen. Men du er nødt til å gjøre det på de rette pasientene, og du må gjøre det kyndig.
Det viser seg at jo sykere barnet er, og når jeg sier syk så snakker jeg om alle disse målene vi har: lungestørrelse, Apgar scorer og blodgasser, jo mer øker ECMO overlevelsessjansen. Ikke alle sykehus er like gode på å holde de mindre syke pasientene borte fra ECMO, og når mindre alvorlig syke barn mottar ECMO-behandling, begynner risikoen ved ECMO å overskygge fordelene. Det finnes både god og dårlig bruk av ECMO, men jeg vil påstå at eksepsjonelt god bruk er nøkkelen for et godt resultat. Vårt mål er å ikke bruke ECMO til de barna som ikke behøver det, men gjøre det på best mulig måte hos de som virkelig trenger det.
Hvem skal få tilbud om ECMO?
Skal vi tilby ECMO til alle, eller er noen pasienter rett og slett for syke til å motta behandling? Hva er utfallet hos de aller sykeste pasientene? For å svare på dette så vi på 270 pasienter som vi har behandlet, og forsøkte å sile ut de 10 % som var de aller sykeste. Hvorfor vil vi finne ut av dette? Fordi de mer alvorlig syke CDH pasientene er i større fare for å bli abortert, eller ha begrensede behandlingsmuligheter etter fødsel fordi behandlende lege ikke tror barnet vil overleve. Legene gjør sitt beste når de kommer med disse spådommene, men er de alltid korrekte? Pasienten jeg snakket om i starten med en pH på 6,64, pCO2 på 130 og PO2 på 15 ville garantert ikke blitt forsøkt holdt i live ved 99 av 100 sykehus. Disse tallene gir et så alvorlig bilde at legene ikke ville ha tilbudt det.
Vi gjorde en retrospektiv gjennomgang av 268 CDH-kasuser, og for å være brutalt ærlig så rapporterer vi hver eneste CDH-baby som kommer inn til oss med et hjerte som fortsatt slår. Vi har tatt imot barn som er født hjemme, døde, ble gjenopplivet og kom inn med pågående hjerte- lungeredning, og kun levde i et par timer. Vi rapporterte dem allikevel i våre data. Babyer har blitt overført til oss etter flertallige hjertestans og ankommet hjernedøde – de ble stadig rapportert i våre data. Hver eneste baby som har blitt behandlet hos oss og som har hatt ett eneste hjerteslag innenfor våre vegger, blir en del av statistikken. Siden resultatene våre er så gode, vet jeg at noen lurer på om vi faktisk behandler de sykeste pasientene, eller om vi er fullstendig ærlige i det vi rapporterer. Det er opp til enhver å ta stilling til, men vi tar imot absolutt alle. Det betyr ikke at vi ikke av og til har barn med flere store anomalier, hvor vi sammen med familien har kommet frem til at behandlingen ikke bør være særlig aggressiv, men selv dette barnet tas med i våre data.
Ut av disse 268 pasientene ble 28 ekskludert fordi de hadde svært alvorlige anomalier ikke forenlig med liv. Så totalt 248 pasienter ble behandlet i et forsøk på å kurere dem, og 172 av dem var født på vårt sykehus. Vi har noen få pasienter som er født andre steder, men majoriteten er født her hos oss. Barna som er født på vårt sykehus er generelt sykere enn de som er født andre steder, og årsaken er så enkel at hvis et veldig sykt barn blir født to timer unna sykehuset, vil det barnet dø to timer unna sykehuset og aldri nå å bli transportert inn. Det samme gjelder om dette barnet blir født ved et sykehus som ikke har utstyr eller kunnskap til å behandle det. Da vil barnet dø på det sykehuset. Blant de som fødes et annet sted og overlever en overføring til vårt sykehus, er altså allerede de sykeste av de syke sortert ut. Men de sykeste av de syke som fødes her hos oss, de har vi ansvar for og de tallene kan vi ikke bortforklare. Så vil du finne det sykehuset som har høyest kompetanse, se etter det som har det største antallet fødsler på huset, og se deretter på hvordan det har gått med dem.
Så, 10 % av 172 er 17 barn. Vi så på alle mulige variabler: Apgar, forventet overlevelse, CO2, pH, tid før ECMO ble tatt i bruk og definerte de 17 aller sykeste pasientene vi har behandlet. Deretter så vi på hvem som overlevde. Vi plottet alt dette inn i en ligning og fikk et soleklart svar på hvem de aller sykeste var. Nesten alle verdiene deres var langt forbi kritisk punkt og så godt som alle behøvde ECMO. Allikevel overlevde neste halvparten. Alle dro hjem med oksygen etter et sykehusopphold på rundt 3-4 måneder. Selv blant de aller, aller sykeste overlevde 8 av 17 barn (47 %). Men det er flere viktige aspekter her: tre av disse barna var ekstremt premature, og vi kunne ikke tilby dem ECMO på grunn av vekt og størrelse. De var født i uke 28 og veide 1000g, uke 27 og veide også 1000g den siste var født i uke 33 og veide 1200g. Ingen av dem kvalifiserte til ECMO og alle tre døde. Dette fikk oss videre til å lure på hvordan det så ut for de sykeste 10 % ut av gruppen av barn hvor alle kvalifiserte for ECMO.
Det viste seg å være en gruppe på 164 barn, og dermed 16 som utgjorde de 10 % som var aller sykest. Ut av disse overlevde 10 barn (63 %). Hver av dem reiste hjem og pustet selv, noen med oksygen, men ikke én med tracheostomi eller hjemmerespirator. Og det er dette jeg mener med potensialet til disse barna! Nå har vi virkelig snudd hver stein for å finne de 10 % som utgjør de aller mest alvorlige tilfellene, og allikevel sett at nesten 2/3 av dem kan overleve. Barnet som jeg gjentatte ganger har brukt som eksempel, med en pH på 6,64 var en av disse. Han reiste hjem uten tracheostomi eller endotrachealtube – han dro hjem og pustet helt selv.
For å oppsummere
De fem fundamentale punktene i CDH-behandling er:
- Ikke skad lungene med ventilering
- Reparer brokket
- Inkluderende bruk av ECMO, selv til de aller sykeste, så lenge som nødvendig
- Kartlegg og behandle risiko (for å kunne time operasjon)
- Ha troen på at barnet kan overleve! Hvis man ikke tror at babyen vil overleve, vil det også bli realiteten.
Så hva er den potensielle overlevelsesraten for CDH?
Vi har altså 268 pasienter, hvor 28 av dem hadde alvorlige anomalier ikke forenlig med liv. Vi rapporterer dem inn og forteller om dem, men vi inkluderer dem ikke i statistikken fordi det ikke ville vært rettferdig å sammenligne et barn med CDH, med et barn med CDH og enkel ventrikkel. Da snakker vi om et fullstendig annet nivå av alvorlighet. Våre data viste at blant 97 barn med LCDH og lever ned, overlevde 99 %, påfølgende overlevde 92 % av 42 barn med RCDH, og til slutt, i en gruppe på 101 barn med LCDH og lever opp, overlevde 75 %. Dette var da vi hadde behandlet 268 pasienter, nå er vi kommet opp i 360. Etter at vi endret risikokartleggingen og timingen for korrigerende kirurgi hos LCDH pasienter med lever opp, har overlevelsesraten for denne gruppen steget til over 90 %. Dette viser at selv de aller sykeste pasientene kan overleve. Over 90 % overlevelse for LCDH med lever opp, hvor standard overlevelsesrate er 45 %! Disse barna har fortsatt uutnyttet potensiale etter hvert som vi blir enda flinkere på å behandle dem.
Kvantitet og kvalitet av overlevelse
Å overleve er kun én del av kampen. Den handler også om hvor godt barna kommer ut av det. Kvantiteten av overlevelse handler om hvor gode vi er til å ta vare på barnas lunger, men kvaliteten av overlevelse handler utelukkende om hvor godt vi tar vare på hjernen. Vi er nødt til å tenke på barnas hjerner hver eneste dag, i hvert eneste steg av behandlingen. Kun da kan vi oppnå det beste mulige utfallet for hjernen i andre enden. Det er ikke enkelt å få disse barna gjennom til den andre siden, de er virkelig syke: de har lavt oksygennivå, høye syreverdier, og de ligger på ECMO. Men for hvert eneste lille punkt hvor vi blir bedre på å behandle dem, øker overlevelsen, og hjernen vil være i en bedre tilstand ved utskrivelse.

Når vi ser disse pasientene igjen på oppfølgingskontroller, ser vi på:
- Lungefunksjon
- Hjertefunksjon
- Mage-tarmfunksjon/refluks/ernæring
- Muskel og skjelett
Pectus excavatum og skoliose - At mellomgulvet fortsatt er intakt
En del barn er utsatt for residiv. Dette mener jeg også at vi kan bli bedre på. Tallene for residiv trenger ikke å være 35 %, de kan være 8 %. - Nevrologisk utvikling
De aller fleste barna har helt normale hjerner. 20-25 % har muligens noen påviselig avvik. Alle våre pasienter får nå utført en MR av hjernen før utskrivelse, da vi føler det er vårt ansvar å kartlegge hvordan hjernen deres ser ut. Alle blir også testet mtp nevrologisk utvikling. Fordi når alt kommer til alt, ønsker vi selv å vite hvordan vi har prestert som behandlende leger.
Å behandle disse barna er ikke enkelt. Det krever at du er konsistent, dedikert, følger prinsippene og jobber hver eneste dag for å bli bedre i det du gjør – men det er mulig. Potensialet barna har til å overleve overgår alt vi noen gang har trodd. Og i takt med at vi blir enda flinkere, blir også fremtiden og livene lysere for barn med CDH. Så godt som alle har nok lunger til både til å overleve og til å virkelig blomste.

Dr. David Kays, MD
Dr. Kays er leder for Center for Congenital Diaphragmatic Hernia (CDH) ved Johns Hopkins All Children’s sykehus i St. Petersburg, Florida. Dette er den første avdelingen i USA som er dedikert utelukkende til CDH-pasienter. Han sitter også som direktør for ECMO-programmet og meddirektør for programmet for fosterdiagnose og behandling. Dr. Kays har mer enn tyve års erfaring med klinisk og forskningsmessig lederskap innenfor behandling av CDH. Forskningen hans har fokusert på å definere de beste behandlingsstrategiene for denne utfordrende neonatale diagnosen og bidratt til betydelige fremskritt i omsorg og resultater.

